Effects of nitrogen fertilizer on microbial community and metabolism in rhizosphere soil of soybean
-
摘要:
探究不同施氮水平下大豆根际固氮微生物群落和代谢差异,对于合理有效的调控根际生态系统、提高土壤养分利用效率等具有重要意义。采用土壤代谢组学和高通量测序技术,研究了不同施氮处理对大豆根际土壤代谢产物与固氮微生物群落结构的影响。结果表明,无氮和施氮处理下大豆根际土壤代谢产物以及土壤固氮菌群落结构差异显著;共检测到29种差异代谢物,包括有机酸、聚酮类化合物、脂肪酰基类化合物、有机含氮化合物等物质;施氮促进大多数代谢物含量上调,且以有机酸及其衍生物含量最高,而下调代谢物仅1种为脂肪酰基类化合物。差异代谢物通路分析表明,差异代谢产物主要富集在氨基酸合成与碳水化合物代谢等途径;此外,施氮处理显著改变固氮微生物群落结构组成,与无氮处理相比大豆根际土壤中慢生根瘤菌属(Bradyrhizobium)、固氮氢自养单胞菌属(Azohydromonas),弗兰克氏菌属(Frankia)以及中华根瘤菌属(Sinorhizobium)等相对丰度显著下降。相关性分析表明根际优势固氮菌慢生根瘤菌属、固氮氢自养单胞菌属以及弗兰克氏菌属同大多数上调代谢物呈显著负相关关系,同下调差异代谢物呈显著正相关关系;中华根瘤菌属同大多数上调代谢物呈显著负相关关系。施氮可能通过影响根系分泌物,从而直接或间接对根际土壤固氮微生物群落结构产生影响。研究结果为不同氮肥处理对大豆根际土壤微生物群落及代谢产物的影响提供了理论基础。
Abstract:It is of great significance to explore the differences of nitrogen-fixing microbial communities and metabolism in the rhizosphere of soybean under different nitrogen applications for reasonable and effective regulation of rhizosphere ecosystems and improvement of soil nutrient use efficiency. Soil metabolomics and high-throughput sequencing techniques were used to study the effects of different nitrogen applications on soil metabolites and nitrogen-fixing microbial community structure in soybean rhizosphere. The results showed that there were significant differences in community structure and soil metabolites of nitrogen-fixing bacteria in soybean rhizosphere soil under no nitrogen treatment and nitrogen treatment. A total of 29 differential metabolites were detected in the experiment, including organic acids, polyketides, fatty acyl compounds, organic nitrogen-containing compounds and other substances. Nitrogen applications promoted the up-regulation of most metabolites. The analysis of differential metabolite pathways showed that differential metabolites were mainly enriched in amino acid synthesis and carbohydrate metabolism. In addition, the nitrogen applications changed the microbial community structure, resulting in a significant decrease in the relative abundance of Bradyrhizobium, Azohydromonas, Frankia and Sinorhizobium in the rhizosphere soil. Correlation analysis showed that inter-rhizosphere dominant nitrogen-fixing bacteria were significantly negatively correlated with most of the up-regulated differential metabolites and significantly positively correlated with the down-regulated differential metabolites. The results provided a theoretical basis for the effects of different nitrogen fertilizations on microbial communities and metabolites in soybean rhizosphere soil.
-
Keywords:
- nitrogen fertilizer /
- diazotrophic community /
- metabolites
-
0 引 言
土壤代谢产物主要来源于植物的根系分泌、根际微生物代谢以及土壤有机质的分解过程等[1],它们通过充当根际微生物的碳源、信号分子等对根际微生物群落结构产生影响,进而对土壤理化性质、作物生长发育等起着关键调节作用[2]。大豆具有共生固氮功能,同时也是需氮较高的作物,施用氮肥会改变土壤微生物代谢及土壤微生物群落结构等微生物学过程,从而直接或间接影响土壤养分和大豆的生长发育[3 − 4]。因此,阐明氮肥施用条件下大豆根际土壤微生物群落和代谢产物的变化规律至关重要。
土壤微生物群落及代谢产物对氮肥的响应是复杂的,目前其影响机制仍有争论[5 − 7]。长期施氮显著降低农田生态系统中固氮微生物的丰度和多样性,而慢生根瘤菌属的相对丰度有所增加[8]。高氮处理使得小麦中参与氮代谢的氨基酸、碳水化合物、有机酸及脂质含量显著上调。此外,施氮引起野生大豆根系中氨基酸类代谢物下调,糖醇、有机酸以及次生代谢类物质上调[9]。以往的研究已证实:施氮会显著改变了土壤代谢产物和土壤微生物群落组成,但目前有关植物根际土壤代谢物研究较少,且缺乏根际土壤代谢组学同根际土壤固氮菌群落的联合研究。本研究选择东北典型黑土与本地主栽大豆品种,通过对大豆施用不同量氮肥,研究不同施氮水平下土壤根际代谢物和固氮微生物群落差异,揭示不同施氮水平下根际土壤代谢物同土壤固氮微生物群落结构之间的联系,将有助于我们认识不同氮素水平下根系分泌物介导的植物-土壤微生物间相互作用过程,对于合理有效的调控根际生态系统、促进作物增产、提高土壤养分利用效率以及生态系统的可持续发展等方面具有重要意义。
1 材料与方法
1.1 试验设计
试验于2021年5月至10月在中国科学院东北地理与农业生态研究所试验场(45°38′N,126°39′E)进行。供试土壤为黑土。供试大豆品种为东生35。试验设置两个施氮水平:(1)CK,不施氮;(2)SN,施氮量为100 mg·kg−1土。采用盆栽试验,每盆(PVC材料,直径20 cm,高45 cm)装土5.5 kg。氮肥在大豆生长发育的V2期,以水溶液的形式随灌溉水施入,每个处理4次重复,随机排列。供试氮肥为尿素(46%N),磷钾肥在土壤装盆前与土壤充分混匀作为基肥,磷肥为过磷酸钙(15% P2O5),钾肥为硫酸钾(52% K2O),施用量均为3 mg·kg−1土。
1.2 样品采集
在大豆播种后第37 d(第4节复叶全展期),即施氮肥后第10天,将完整的大豆根系从盆栽土壤中取出,轻轻抖落以去除松散粘附在根系的根区土壤,将未抖落紧密粘附在根系的土壤(< 2 mm厚度)用毛刷刷下即为根际土壤。将获得的不同处理下的根际土壤样品用无菌袋迅速带回实验室过2 mm筛后保存在−80 ℃冰箱,用于土壤代谢物和固氮微生物的群落结构的分析。
1.3 固氮微生物群落结构测定
固氮微生物群落结构测定参照Jonathan等[10]实验方法。称取0.5 g新鲜土壤,采用FastDNA SPIN试剂盒(MP Biomedicals,USA)提取土壤总DNA[11]。使用引物对nifH-F/nifH-R(5'-AAAGGYGGYGGWATCGGYAARTCCAC-3')/(5'-TTGTTSGCSGCRTACATSGCCATSGCCAT-3')扩增nifH基因。PCR在含有4 μL 5×FastPfu缓冲液、2 μL dNTPs、正向引物与反向引物各0.8 μL、0.4 μLFastPfu聚合酶、10 ng模板DNA和双蒸水的20 μL反应体系中进行。扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环,72 ℃ 10 min。采用1%琼脂糖凝胶电泳检测扩增产物在Illumina MiSeq PE 300上测序[12]。
测序后,使用QIIME Pipeline(Version 1.9.0)处理原始数据,去除长度小于200 bp或平均碱基质量得分小于20的序列后使用Fun Gene Pipeline工具转化为氨基酸序列,质控后使用UPARSE软件按照97%的相似性水平,将高质量序列进行OTU聚类,从每个OTU中选取具有代表性的序列翻译成氨基酸序列,在NCBI网站(https://blast.ncbi.nlm. nih.gov/)进行分类鉴定。
1.4 土壤代谢物提取及测定
代谢物质提取参照Ma等[13]提出的试验方法,具体如下:称取0.2 g新鲜土样放入2 mL Eppendorf管中,加入80%的甲醇800 μL和800 μL乙酸乙酯,震荡,超声15 min,4 ℃,12 000 g离心20 min,取上清液,真空浓缩,浓缩后,每管加入80%甲醇100 μL复溶,取10 μL上清液测定。
液相色谱分离在Dionex Ulti Mate 3000系统上进行。在正/负极性切换模式下,采用了反相液相色谱(Reverse Phase Liquid Chromatography,RPLC)和亲水作用色谱(Hydrophilic interaction chromatography,HILIC)两种单独的检测方法,两种方法的色谱条件见表1。
表 1 液相色谱条件Table 1 Liquid chromatography conditions色谱方法
Chromatographic method反相液相色谱
Reverse Phase Liquid Chromatography亲水作用色谱
Hydrophilic interaction chromatography色谱柱
Phase columnZORBAX SB-Aq C18
(100 mm× 2.1 mm,1.8 μm)ACQUITY BEH Amide
(150 mm× 2.1 mm,1.7 μm)柱温 Column temperature/℃ 40 50 流动相A
Mobile phase A0.1%甲酸水溶液
0.1% Formic acid solution10 mM甲酸铵+30%乙腈/水(v/v)+0.1%甲酸
10 mM Ammonium formate+30% Acetonitrile/Water(v/v)+0.1% Formic acid
流动相B
Mobile phase B0.1%甲酸乙腈溶液
0.1% Acitrile formate solution10 mM甲酸铵+95%乙腈/水(v/v)+0.1%甲酸
10 mM Ammonium formate+95% Acetonitrile/
Water(v/v)+0.1% Formic acid
流速Velocity/(mL·min−1) 0.3 0.3 梯度洗脱设定
Gradient elution setting0 ~ 10 min,95% A-5% A;10 ~ 11 min,
5% A-5% A;11 ~ 11.5 min,5% A-95% A;
11.5 ~ 14.5 min,95% A-95% A0 ~ 1 min,0% A–0% A;1 ~ 8 min,0% A–80% A;8 ~ 9 min,80% A-80% A;9 ~ 9.5 min,
80% A-0% A;9.5 ~ 13.5 min,0% A-0% A质谱仪设定参照Ma等[13]的质谱仪设定参数F。使用了配备有加热的电喷雾电离源的Q Exactive质谱仪(赛默飞世尔科技公司)。正模式喷雾电压3.5 kV,负模式喷雾电压3.0 kV。毛细管温度设定为320 ℃。鞘气和辅助气体分别设置为40个和5个任意单位的流量,采用了两种采集模式。HILIC分析在m/z范围为70 ~ 1000的全扫描模式下分析质控(Quality Control,QC)样本,土样和空白对照样品,分辨率为70,000半峰全宽(FWHM),自动增益控制(AGC)目标为1e5,最大注入时间为50 ms,以随机顺序注射土壤样品,减少系统偏差。RPLC分析参数如下:分辨率为17 500 (FWHM)、AGC目标为1e5、最大注入时间50 ms、阶梯式碰撞(NCE15、40、60)和前10个峰值的循环计数。为QC设置了不同的m/z范围(70-125,120-175,170-225,220-275,270-325,320-405,400-1000,70-1000)以最大化MS2光谱。
1.5 数据统计分析
固氮微生物组间差异统计分析(STAMP)采用doBy包和ggplot2包(R version 4.1.3);对于使用RPLC和HILIC测定法检测到的代谢物,使用具有较高保留时间的方法的峰面积进行定量,采用SIMCA 14.1(Umetrics,Umea,瑞典)对代谢组数据进行Pareto标准化处理、无监督主成分分析(PCA,Principal Component Analysis)、正交偏最小二乘法判别分析(OPLS-DA,Orthogonal Partial Least Squares-Discriminant Analysis),OPLS-DA模型的验证使用200次迭代的置换测试测试[14],判断模型是否“过拟合”,能否能较好的描述样本,作为模型生物标记物群寻找的前提。SPSS22.0进行t检验(Student's t-text),采用OPLS-DA中的S-plot、变量权重值(VIP,variable important in projection)结合t检验p值与差异倍数(FC,fold change)筛选出不同施氮水平下大豆根际土壤中的差异性代谢物;采用MetaboAnalyst 5.0进行聚类分析和KEGG通路分析[15];采用scipy(Python)Version1.0.0进行相关性分析。
2 结果与分析
2.1 土壤固氮微生物群落结构组成
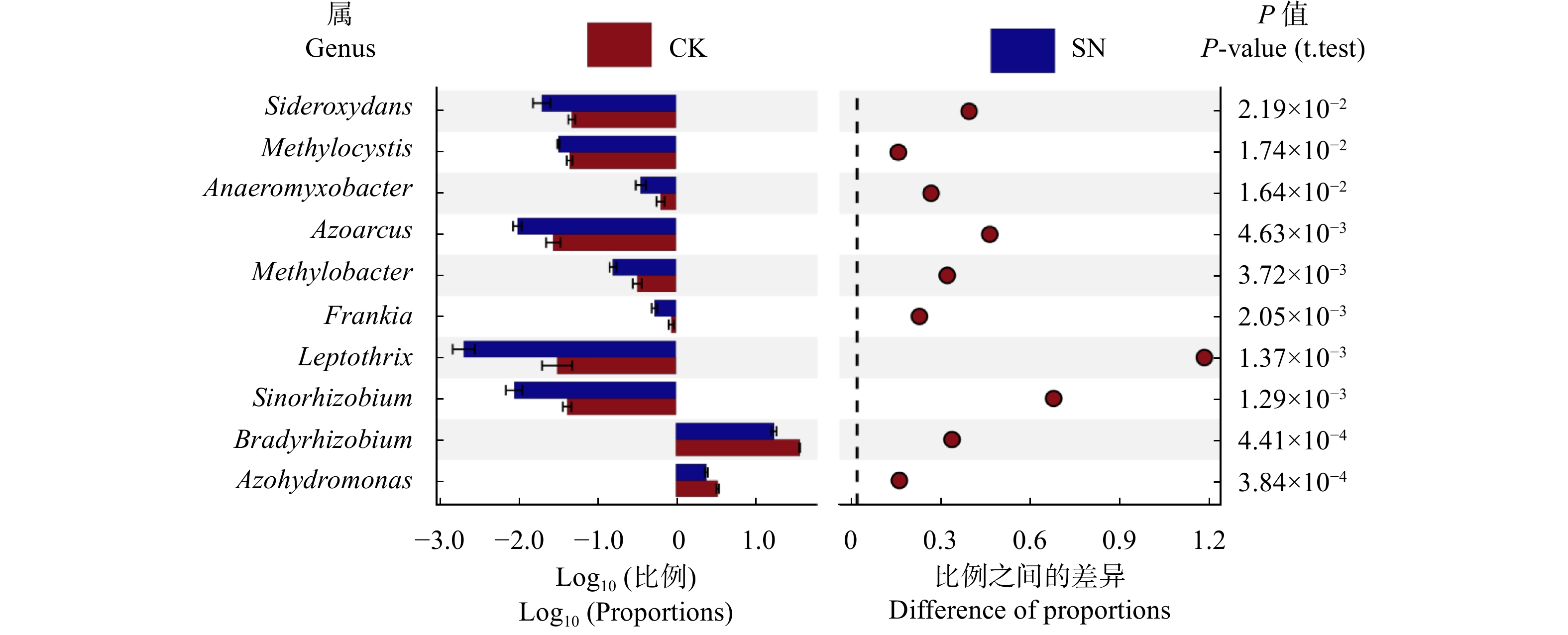
不同施氮处理下的固氮微生物在属水平上的优势固氮菌均为慢生根瘤菌属(Bradyrhizobium)、固氮氢自养单胞菌属(Azohydromonas)、甲基胞囊菌属(Methylocystis)、纤发菌属(Leptothrix)、固氮弯曲菌属(Azoarcus)、铁氧化菌属(Sideroxydans)、厌氧黏杆菌属(Anaeromyxobacter)、甲基杆状菌属(Methylobacter)、弗兰克氏菌属(Frankia)、中华根瘤菌属(Sinorhizobium),其中Bradyrhizobium为绝对优势菌属相对丰度>15%(图1)。但SN处理下的不同优势固氮菌属的相对丰度均显著低于对应的CK处理(P < 0.05)。
2.2 土壤代谢物代谢图谱及主成分分析
不同施氮处理下检测出的大豆根际土壤代谢物共有10类83种,包括17种有机酸、13种有机杂环化合物、13种脂肪酰基、6种有机含氮化合物、6种聚酮类化合物、5种苯环型化合物、4种核酸及其衍生物、2种碳水化合物、1种生物碱及16种其它类化合物。有机酸、有机杂环化合物和脂肪酰基为占比最多的类别,分别占代谢物总数的15.7% ~ 20.5%,其次为有机含氮化合物(7.23%)、聚酮类化合物(7.23%)和苯环型化合物(6.02%)。
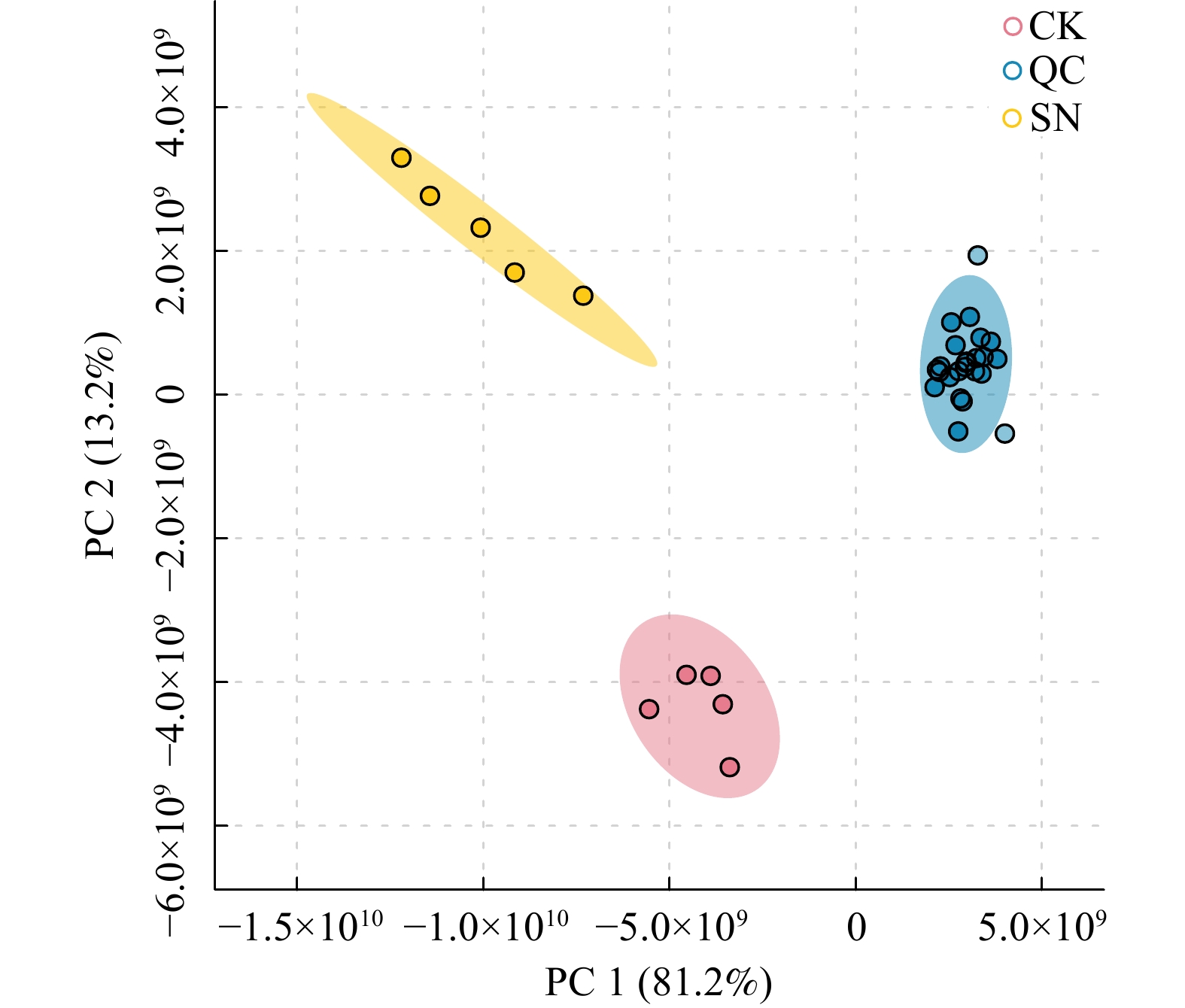
将所有土壤样本及质控样本QC提取得到的峰,经Pareto-scaling处理后进行PCA分析(图2),SN与CK处理的根际土壤代谢物明显分离,QC样本聚类,模型R2X = 0.949,其余参数数值均>0.5,且均在置信区间,表明该研究数据集具有较高的稳定性和可重复性,可用于不同施氮处理下的大豆根际土壤代谢物差异分析。
2.3 土壤差异代谢物
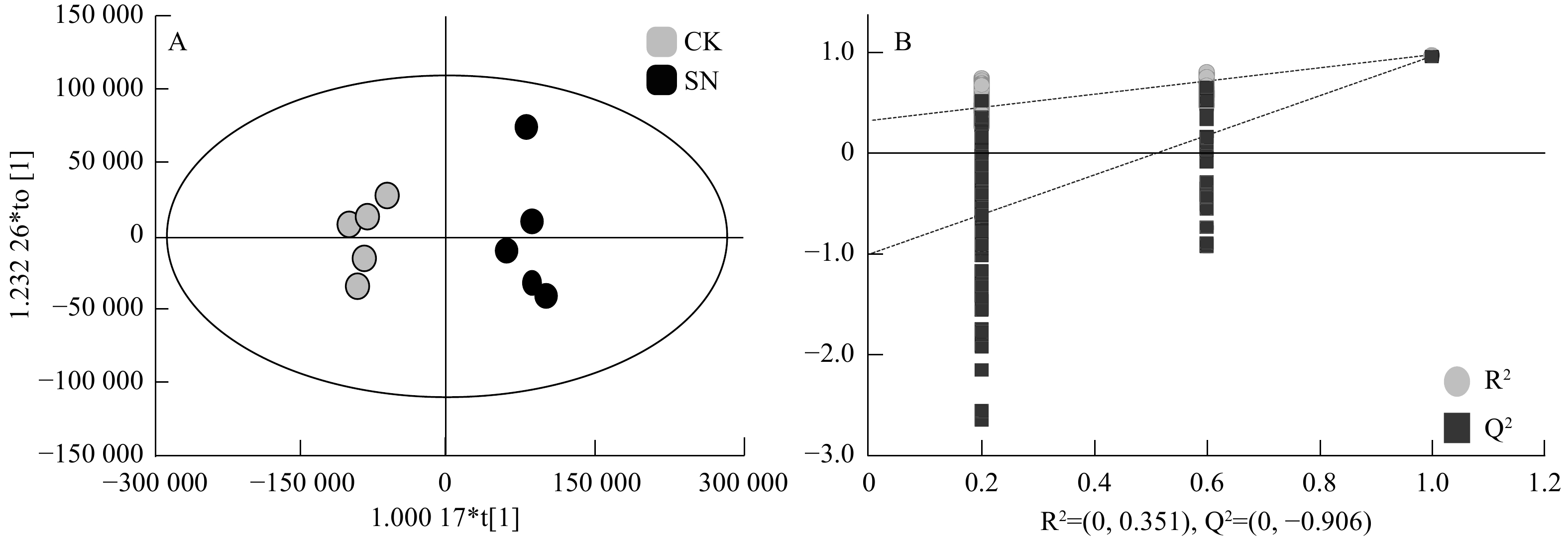
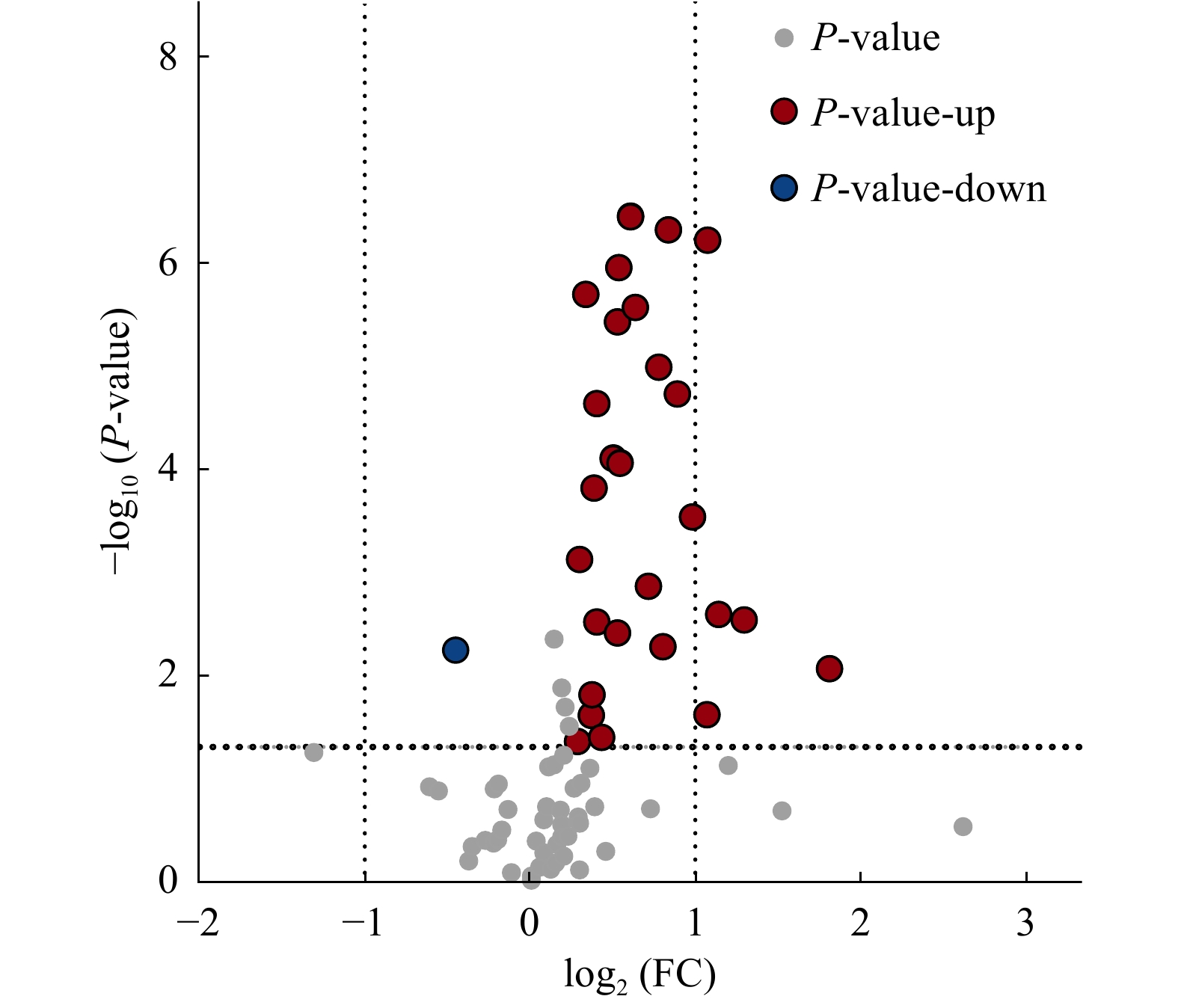
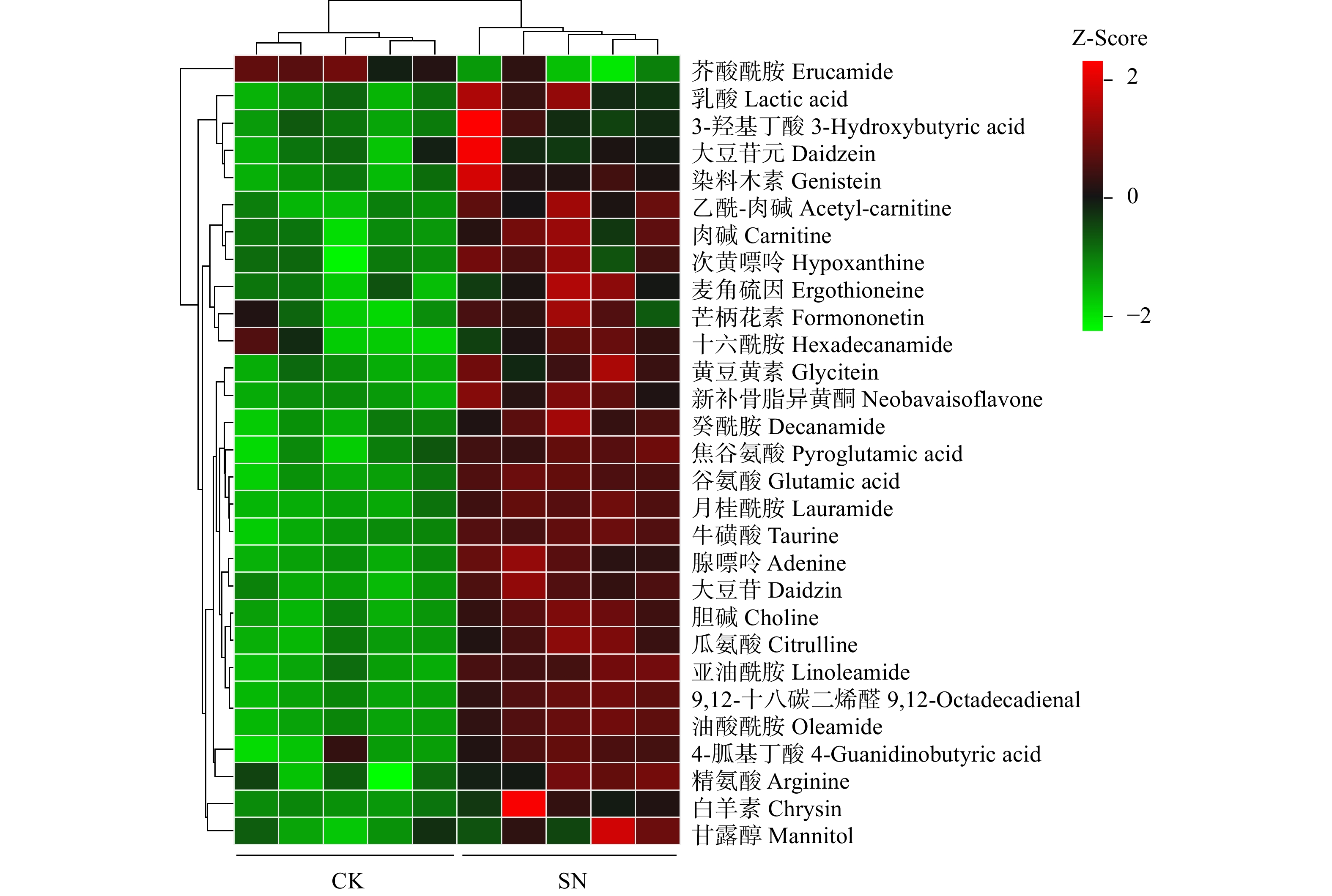
采用OPLS-DA模型筛选差异代谢物,累计解释能力参数R2X和R2Y分别为0.922和0.978,预测能力参数Q2 = 0.961,参数均大于0.4,表明此模型可靠,对模型进行随机分组200次的置换检验(Permutation text),Q2回归直线与Y轴的截距小于0,该模型不存在过拟合现象(图3)。基于OPLS-DA模型,采用变量权重值VIP并结合t检验 P值与差异倍数FC进行差异性表达代谢物筛选。设置VIP阈值≥ 1,P < 0.05且FC > 1.2或FC < 0.83,在CK和SN处理下根际土壤中筛选出29种显著性差异的代谢物。与CK处理相比,SN处理的大豆根际土壤有28种代谢物表达量上调,其中包括8种有机酸、7种聚酮类化合物、6种脂肪酰基类化合物、2种核酸及其衍生物、2种有机含氮化合物、1种有机杂环化合物、1种碳水化合物和1种其它类化合物(表2)。其中,油酸酰胺(Oleamide)、9,12-十八碳二烯醛(9,12-Octadecadienal)、牛磺酸(Taurine)、月桂酰胺(Lauramide)、谷氨酸(Glutamic acid)、胆碱(Choline)、亚油酰胺(Linoleamide)、大豆苷(Daidzin)、腺嘌呤(Adenine)等代谢物差异倍数FC ≥ 1.5倍。此外,脂肪酰基类化合物芥酸酰胺(Erucamide)相对含量显著下降(P < 0.05),其差异倍数FC介于1.2 ~ 1.5倍之间(图4和图5)。
表 2 不同施氮处理下大豆根际土壤差异代谢物Table 2 Differential metabolites in soybean rhizosphere soil under different nitrogen fertilizations代谢物
MetabolitesVIP值
VIP差异倍数
Fold changelog2
(FC)P值
P value变化趋势
Trends in changes芥酸酰胺Erucamide 1.255 0.733 −0.448 <0.01 下调Down 油酸酰胺Oleamide 1.540 1.526 0.610 <0.001 上调Up 9,12-十八碳二烯醛9,12-Octadecadienal 1.540 1.527 0.611 <0.001 上调Up 牛磺酸Taurine 1.540 1.791 0.841 <0.001 上调Up 月桂酰胺Lauramide 1.539 2.111 1.078 <0.001 上调Up 谷氨酸Glutamic acid 1.535 1.454 0.540 <0.001 上调Up 胆碱Choline 1.526 1.267 0.342 <0.001 上调Up 亚油酰胺Linoleamide 1.520 1.560 0.642 <0.001 上调Up 大豆苷Daidzin 1.518 1.444 0.530 <0.001 上调Up 腺嘌呤Adenine 1.505 1.717 0.780 <0.001 上调Up 新补骨脂异黄酮Neobavaisoflavone 1.494 1.858 0.894 <0.001 上调Up 瓜氨酸Citrulline 1.491 1.324 0.404 <0.001 上调Up 癸酰胺Decanamide 1.469 1.421 0.507 <0.001 上调Up 焦谷氨酸Pyroglutamic acid 1.468 1.463 0.549 <0.001 上调Up 乙酰-肉碱Acetyl-carnitine 1.447 1.312 0.392 <0.001 上调Up 黄豆黄素Glycitein 1.419 1.982 0.987 <0.001 上调Up 肉碱Carnitine 1.386 1.232 0.301 <0.001 上调Up 染料木素Genistein 1.348 1.646 0.719 <0.01 上调Up 乳酸Lactic Acid 1.313 2.211 1.145 <0.01 上调Up 次黄嘌呤Hypoxanthine 1.309 2.461 1.299 <0.01 上调Up 4-胍基丁酸4-Guanidinobutyric acid 1.294 1.324 0.405 <0.01 上调Up 精氨酸Arginine 1.279 1.447 0.533 <0.01 上调Up 麦角硫因Ergothioneine 1.259 1.750 0.807 <0.01 上调Up 白羊素Chrysin 1.213 3.513 1.813 <0.01 上调Up 芒柄花素Formononetin 1.152 1.297 0.375 <0.05 上调Up 3-羟基丁酸3-Hydroxybutyric acid 1.095 2.104 1.073 <0.05 上调Up 甘露醇Mannitol 1.095 1.295 0.373 <0.05 上调Up 大豆苷元Daidzein 1.026 1.351 0.434 <0.05 上调Up 十六酰胺Hexadecanamide 1.007 1.223 0.290 <0.05 上调Up 2.4 土壤代谢物代谢途径
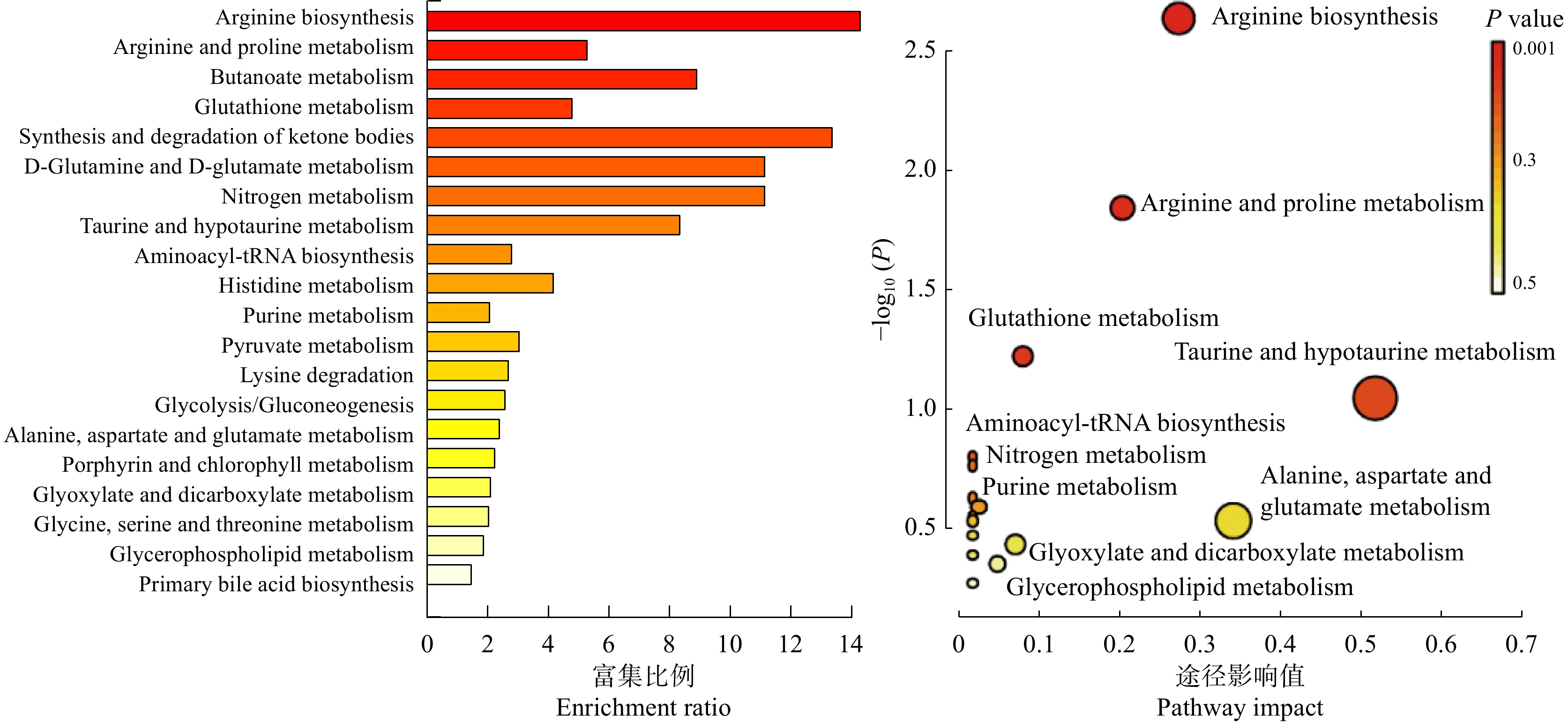
不同施氮水平影响大豆根际不同土壤代谢物相互作用,形成不同的代谢途径(图6)。不同处理的代谢相关通路包括:精氨酸生物合成(Arginine biosynthesis)、精氨酸和脯氨酸代谢(Arginine and proline metabolism)、谷胱甘肽代谢(Glutathione metabolism)、氨基酰基-tRNA生物合成(Aminoacyl-tRNA biosynthesis)、牛磺酸和亚牛磺酸代谢(Taurine and hypotaurine metabolism)、嘌呤代谢(Purine metabolism)、氮代谢(Nitrogen metabolism)、丁酸盐代谢(Butanoate metabolism)、玉米素生物合成(Zeatin biosynthesis)、丙酮酸代谢(Pyruvate metabolism)、苯丙氨酸、酪氨酸和色氨酸生物合成(Phenylalanine, tyrosine and tryptophan biosynthesis)、甘氨酸、丝氨酸和苏氨酸代谢(Glycine, serine and threonine metabolism),这些通路主要参与大豆根际土壤氨基酸合成与碳水化合物代谢途径,其中精氨酸生物合成、精氨酸和脯氨酸代谢差异显著(P < 0.05)。由表2可知,SN处理下精氨酸生物合成途径中谷氨酸(L-Glutamate)、瓜氨酸(L-Citrulline)和精氨酸(L-Arginine)相对含量显著上升;精氨酸和脯氨酸代谢途径中除了精氨酸(L-Arginine)和谷氨酸(L-Glutamate)相对含量显著上升外,4-胍基丁酸(4-Guanidinobutanoate)的相对含量亦显著上升。
2.5 土壤固氮微生物群落与差异代谢产物的相关性
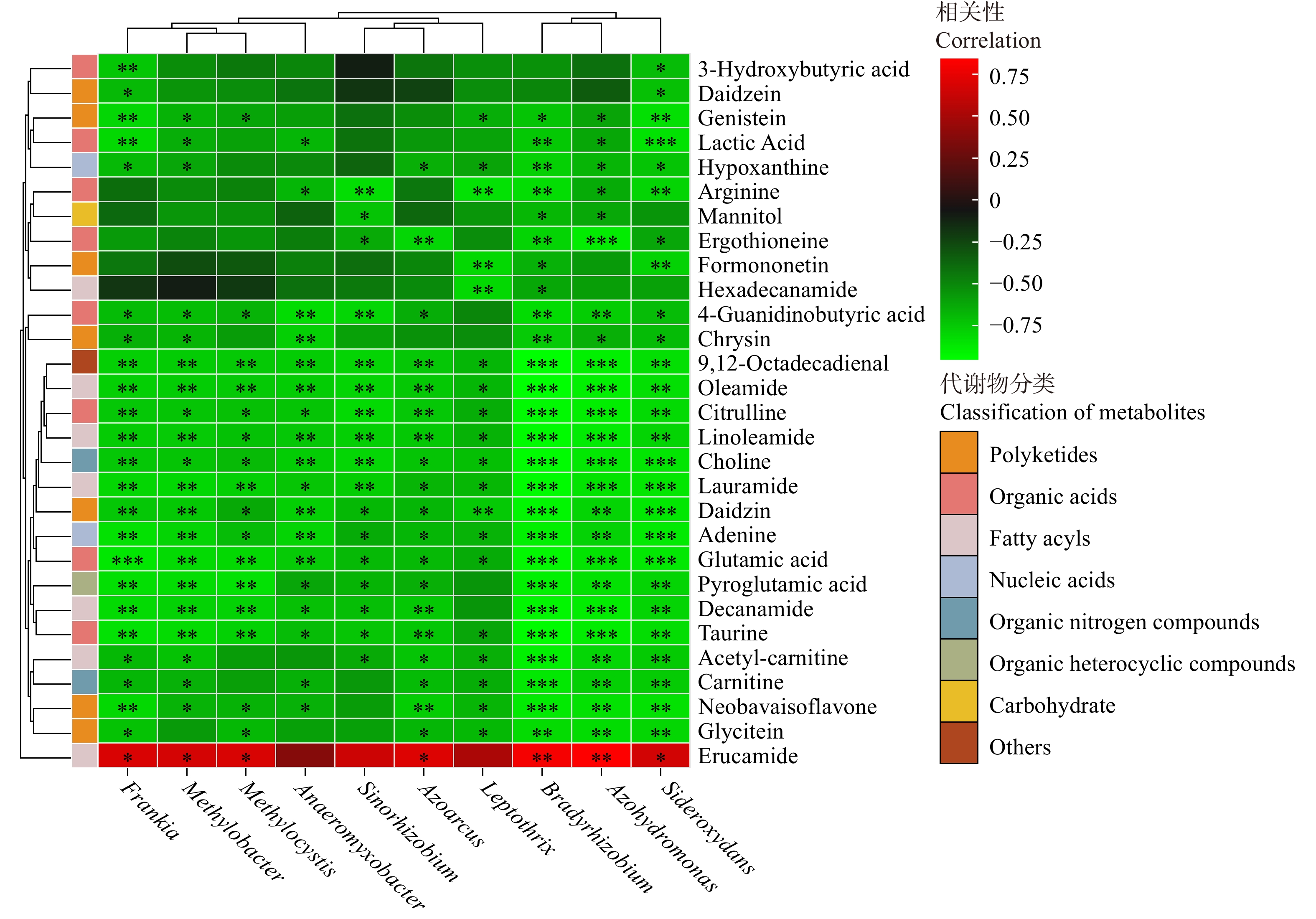
慢生根瘤菌属(Bradyrhizobium)、固氮氢自养单胞菌属(Azohydromonas)与超85%的上调差异代谢物呈显著负相关关系(P < 0.05),其中与上调代谢物9,12-十八碳二烯醛(9,12-Octadecadienal)、油酸酰胺(Oleamide)、瓜氨酸(Citrulline)、月桂酰胺(Lauramide)、谷氨酸(Glutamic acid)、牛磺酸(Taurine)等超60%的上调差异代谢物呈极显著负相关关系(P < 0.01,图7)。
铁氧化属细菌(Sideroxydans)与超90%的上调差异代谢物呈显著负相关关系(P < 0.05),其中与乳酸(Lactic Acid)、胆碱(Choline)、月桂酰胺(Lauramide)、大豆苷(Daidzin)、腺嘌呤(Adenine)、谷氨酸(Glutamic acid)等超70%的上调差异代谢物呈极显著负相关关系(P<0.01)。弗兰克氏菌属(Frankia)与超80%的上调差异代谢物呈显著负相关关系(P < 0.05),其中与3-羟基丁酸(3-Hydroxybutyric acid)、染料木素(Genistein)、乳酸(Lactic Acid)、9,12-十八碳二烯醛(9,12-Octadecadienal)、谷氨酸(Glutamic acid)等超55%的上调差异代谢物呈极显著负相关关系(P < 0.01)。
纤发菌属(Leptothrix)同超65%的上调差异代谢物显著负相关(P < 0.05),其中同精氨酸(Arginine)、芒柄花素(Formononetin)、十六碳酰胺(Hexadecanamide)、大豆苷(Daidzin)等超10%的上调代谢产物呈极显著负相关关系(P < 0.01)。
固氮弯曲菌属(Azoarcus)、中华根瘤菌(Sinorhizobium)与超60%的上调差异代谢物呈显著负相关关系(P < 0.05),其中与4-胍基丁酸(4-Guanidinobutyric acid)、9,12-十八碳二烯醛(9,12-Octadecadienal)、油酸酰胺(Oleamide)、亚油酰胺(Linoleamide)、胆碱(Choline)等超25%的上调差异代谢物呈极显著负相关关系(P < 0.01)。厌氧黏杆菌属(Anaeromyxobacter)与超60%的上调代谢物呈显著负相关关系(P < 0.05),其中与4-胍基丁酸(4-Guanidinobutyric acid)、白杨黄素(Chrysin)、9,12-十八碳二烯醛(9,12-Octadecadienal)、油酸酰胺(Oleamide)、瓜氨酸(Citrulline)等超30%的上调差异代谢物呈极显著负相关关系(P < 0.01)。
甲基胞囊菌属(Methylocystis)、甲基杆状菌属(Methylobacter)与超55%的上调差异代谢物呈显著负相关关系(P < 0.05),其中与9,12-十八碳二烯醛(9,12-Octadecadienal)、油酸酰胺(Oleamide)、月桂酰胺(Lauramide)、癸酰胺(Decanamide)、焦谷氨酸(Pyroglutamic acid)、牛磺酸(Taurine)等超25%的上调差异代谢物呈极显著负相关关系(P < 0.01)。
慢生根瘤菌属(Bradyrhizobium)、固氮氢自养单胞菌属(Azohydromonas)与下调差异代谢物芥酸酰胺(Erucamide)呈极显著正相关关系(P < 0.01);铁氧化属细菌(Sideroxydans)、弗兰克氏菌属(Frankia)、固氮弯曲菌属(Azoarcus)、甲基胞囊菌属(Methylocystis)、甲基杆状菌属(Methylobacter)与下调差异代谢物芥酸酰胺(Erucamide)呈显著正相关关系(P < 0.05)。
3 讨 论
3.1 不同施氮处理对大豆根际代谢物质的影响
土壤中的氨基酸、脂质、黄酮以及苯基丙类化合物等代谢产物对氮较敏感[16]。Shi等[17]研究表明,施氮对枸杞中黄酮类、氨基酸、多糖等代谢产物有显著影响,其中黄酮类化合物随着施氮量的增加而显著上调。Zhen等[18]研究表明,小麦高氮处理下参与氮代谢的氨基酸、碳水化合物、有机酸及脂质含量显著上调。Liu等[9]研究表明,施氮处理下野生大豆根系中氨基酸类代谢物下调,糖醇、有机酸以及次生代谢类物质上调。本研究中SN处理相较于CK处理,96.6%(28/29)的差异代谢物上调,且以有机酸及其衍生物含量最高,而下调代谢物仅1种为脂肪酰基类化合物—芥酸酰胺(Erucamide)。对于豆科作物,脂类物质对根瘤的形成和发育至关重要,脂肪酰胺类物质是一类含氮的脂溶性化合物,在豆科作物根部氮循环过程中充当碳底物以及复杂的信号传导功能[19−20],脂肪酰基类化合物多为脂肪酰胺类化合物,在施氮处理下该类化合物绝大多数情况下是上调的,是调节大豆根际与土壤关系的重要物质[21]。本研究中将差异倍数(FC)上调至1.5倍以上后,上调差异代谢物主要为脂肪酰基类化合物,而无下调差异代谢物,有关脂肪酰基类化合物的调节作用需要在以后的研究中开展深入研究。
3.2 不同施氮处理对大豆根际代谢通路的影响
同一植物在响应不同环境条件时采取的策略往往不同,即根际代谢产物的途径和通路有差异[22 − 24]。本研究通过对不同施氮水平的大豆根际土壤代谢物分析,共得到16条相关代谢通路,其中有7条代谢通路同氨基酸合成有关,4条同碳水化合物代谢相关,表明大豆根际土壤氨基酸合成与碳水化合物代谢受氮肥的影响较大。其中,精氨酸生物合成、精氨酸和脯氨酸代谢两条通路差异最为明显,参与该代谢通路的特异性代谢物均显著上调,谷氨酸、瓜氨酸、精氨酸均被富集到了该通路上。谷氨酸可为植物中含氮化合物的生物合成提供前体,精氨酸具有贮藏氮素营养的功能[25 − 26]。有研究表明在高硝态氮水平下,烟草根系中与苯丙氨酸、酪氨酸和色氨酸生物合成的相关基因表达量上调[27]。在本研究中SN处理下,富集至苯丙氨酸、酪氨酸和色氨酸生物合成等代谢通路的代谢物含量显著上调,因此氮素是调控根际氨基酸生物合成的重要因素[28]。
3.3 不同施氮处理对大豆根际土壤差异代谢产物与固氮微生物群落相关性的影响
根际土壤中的代谢物来源多样,其中植物根系分泌物和微生物产生的次生代谢产物是根际土壤代谢产物的最主要来源[1],而根系分泌物作为植物-根际微生物相互作用的介质,是微生物的重要营养来源[29 − 30],其含量及其组成的变化能对根际微生物造成影响,同时根际微生物群落构成的不同又会对根系分泌物造成影响,二者相互作用,彼此影响[4]。
以往的研究已证实,施氮会导致固氮微生物群落更容易受到外部环境的影响,从而改变共生关系[5 − 7]。慢生根瘤菌属、中华根瘤菌、固氮氢自养单胞菌属为属于革兰氏阴性变形菌,弗兰克氏菌属为丝状革兰氏阳性放线菌,这些固氮微生物均可作为土壤腐生菌或植物内生菌(根瘤内部)参与根际土壤氮循环[31],对氮较为敏感,目前普遍认为在高氮水平下其丰度随供氮水平的增加而显著降低[32 − 34]。本研究中施氮SN处理与CK相比,显著降低了慢生根瘤菌属、固氮氢自养单胞菌属、中华根瘤菌属以及弗兰克氏菌属的相对丰度),主要是由于施氮肥改变了土壤理化性质或影响固氮微生物与其它土壤微生物间的竞争关系,从而直接或间接影响根际固氮微生物的丰度与组成[35]。
进一步分析固氮微生物菌群与代谢物之间的相互关系表明,慢生根瘤菌属、固氮氢自养单胞菌属以及弗兰克氏菌属同大多数上调代谢物显著负相关,同下调差异代谢物显著正相关;中华根瘤菌属同大多数上调代谢物显著负相关(图7)。SN处理根际土壤代谢产物相对丰度增加,可能是由于施氮增加了土壤的速效氮含量,促使大豆向根系分泌更多有机物质,而这类有机物质可以通过充当根际微生物的简单碳底物、信号分子以及促进微生物活性等途径对根际微生物代谢以及群落结构产生影响[2]。结合代谢物与根际固氮微生物变化趋势表明,施氮处理可能通过提高土壤养分,影响根系分泌物,从而直接或间接对根际土壤固氮微生物群落结构产生影响。
4 结 论
不同施氮处理对大豆根际土壤固氮微生物群落结构组成和代谢物影响显著,施氮显著降低优势固氮菌的相对丰度,但有利于根际土壤中有机酸及其衍生物、脂肪酰基类化合物、聚酮类化合物等代谢物的积累。施氮处理下的优势固氮菌属同大多数特异性代谢物均有显著相关关系,其中慢生根瘤菌属、固氮氢自养单胞菌属以及弗兰克氏菌属同大多数上调代谢物呈显著负相关关系,同下调差异代谢物呈显著正相关关系;而中华根瘤菌属同大多数上调代谢物呈显著负相关关系。本研究有利于增加对根系分泌物和根际土壤固氮微生物在大豆生长发育过程中相互作用的了解,但施氮处理后,大豆根际土壤代谢产物的动态变化及其与根际土壤固氮微生物多样性、群落结构的关系仍需进行更加系统的研究。
-
表 1 液相色谱条件
Table 1 Liquid chromatography conditions
色谱方法
Chromatographic method反相液相色谱
Reverse Phase Liquid Chromatography亲水作用色谱
Hydrophilic interaction chromatography色谱柱
Phase columnZORBAX SB-Aq C18
(100 mm× 2.1 mm,1.8 μm)ACQUITY BEH Amide
(150 mm× 2.1 mm,1.7 μm)柱温 Column temperature/℃ 40 50 流动相A
Mobile phase A0.1%甲酸水溶液
0.1% Formic acid solution10 mM甲酸铵+30%乙腈/水(v/v)+0.1%甲酸
10 mM Ammonium formate+30% Acetonitrile/Water(v/v)+0.1% Formic acid
流动相B
Mobile phase B0.1%甲酸乙腈溶液
0.1% Acitrile formate solution10 mM甲酸铵+95%乙腈/水(v/v)+0.1%甲酸
10 mM Ammonium formate+95% Acetonitrile/
Water(v/v)+0.1% Formic acid
流速Velocity/(mL·min−1) 0.3 0.3 梯度洗脱设定
Gradient elution setting0 ~ 10 min,95% A-5% A;10 ~ 11 min,
5% A-5% A;11 ~ 11.5 min,5% A-95% A;
11.5 ~ 14.5 min,95% A-95% A0 ~ 1 min,0% A–0% A;1 ~ 8 min,0% A–80% A;8 ~ 9 min,80% A-80% A;9 ~ 9.5 min,
80% A-0% A;9.5 ~ 13.5 min,0% A-0% A表 2 不同施氮处理下大豆根际土壤差异代谢物
Table 2 Differential metabolites in soybean rhizosphere soil under different nitrogen fertilizations
代谢物
MetabolitesVIP值
VIP差异倍数
Fold changelog2
(FC)P值
P value变化趋势
Trends in changes芥酸酰胺Erucamide 1.255 0.733 −0.448 <0.01 下调Down 油酸酰胺Oleamide 1.540 1.526 0.610 <0.001 上调Up 9,12-十八碳二烯醛9,12-Octadecadienal 1.540 1.527 0.611 <0.001 上调Up 牛磺酸Taurine 1.540 1.791 0.841 <0.001 上调Up 月桂酰胺Lauramide 1.539 2.111 1.078 <0.001 上调Up 谷氨酸Glutamic acid 1.535 1.454 0.540 <0.001 上调Up 胆碱Choline 1.526 1.267 0.342 <0.001 上调Up 亚油酰胺Linoleamide 1.520 1.560 0.642 <0.001 上调Up 大豆苷Daidzin 1.518 1.444 0.530 <0.001 上调Up 腺嘌呤Adenine 1.505 1.717 0.780 <0.001 上调Up 新补骨脂异黄酮Neobavaisoflavone 1.494 1.858 0.894 <0.001 上调Up 瓜氨酸Citrulline 1.491 1.324 0.404 <0.001 上调Up 癸酰胺Decanamide 1.469 1.421 0.507 <0.001 上调Up 焦谷氨酸Pyroglutamic acid 1.468 1.463 0.549 <0.001 上调Up 乙酰-肉碱Acetyl-carnitine 1.447 1.312 0.392 <0.001 上调Up 黄豆黄素Glycitein 1.419 1.982 0.987 <0.001 上调Up 肉碱Carnitine 1.386 1.232 0.301 <0.001 上调Up 染料木素Genistein 1.348 1.646 0.719 <0.01 上调Up 乳酸Lactic Acid 1.313 2.211 1.145 <0.01 上调Up 次黄嘌呤Hypoxanthine 1.309 2.461 1.299 <0.01 上调Up 4-胍基丁酸4-Guanidinobutyric acid 1.294 1.324 0.405 <0.01 上调Up 精氨酸Arginine 1.279 1.447 0.533 <0.01 上调Up 麦角硫因Ergothioneine 1.259 1.750 0.807 <0.01 上调Up 白羊素Chrysin 1.213 3.513 1.813 <0.01 上调Up 芒柄花素Formononetin 1.152 1.297 0.375 <0.05 上调Up 3-羟基丁酸3-Hydroxybutyric acid 1.095 2.104 1.073 <0.05 上调Up 甘露醇Mannitol 1.095 1.295 0.373 <0.05 上调Up 大豆苷元Daidzein 1.026 1.351 0.434 <0.05 上调Up 十六酰胺Hexadecanamide 1.007 1.223 0.290 <0.05 上调Up -
[1] ZHANG H L,HUANG M,ZHANG W H,et al. Silver nanoparticles alter soil microbial community compositions and metabolite profiles in unplanted and cucumber-planted soils[J]. Environmental Science and Technology,2020,54 (6):3334−3342.
[2] MASSALHA H,KORENBLUM E,THOLL D,et al. Small molecules below-ground: the role of specialized metabolites in the rhizosphere[J]. The Plant Journal,2017,90 (4):788−807. DOI: 10.1111/tpj.13543
[3] LU X K,MAO Q G,GILLIAM F S,et al. Nitrogen deposition contributes to soil acidification in tropical ecosystems[J]. Global Change Biology,2014,20 (12):3790−3801. DOI: 10.1111/gcb.12665
[4] 李乌日吉木斯,高欣梅,徐兴健,等. 氮肥种类及用量对旱地玉米肥料利用率和产量的影响[J]. 土壤与作物,2019,8(4):415−426. LI W,GAO X M,XU X J,et al. Effects of N fertilizer type and rate on maize fertilizer utilization efficiency and yield in arid farmland[J]. Soils and Crops,2019,8 (4):415−426.
[5] 代迪,字洪标,杨有芳,等. 高寒草甸土壤微生物功能多样性对氮肥添加的响应[J]. 水土保持研究,2018,25(2):137−144. DAI D,ZI H B,YANG Y F,et al. Responses of soil microbial functional diversity to nitrogen addition in an alpine meadow on northwestern plateau of Sichuan Province[J]. Research of Soil and Water Conservation,2018,25 (2):137−144.
[6] 徐润宏,谭梅,刘泽华,等. 高寒湿地土壤微生物区系组成对氮添加的响应[J]. 生态科学,2022,41(1):120−128. XU R H,TAN M,LIU Z H,et al. Response of microbial flora to nitrogen addition in alpine wetlands[J]. Ecological Science,2022,41 (1):120−128.
[7] LI B B,ROLEY S S,DUNCAN D S,et al. Long-term excess nitrogen fertilizer increases sensitivity of soil microbial community to seasonal change revealed by ecological network and metagenome analyses[J]. Soil Biology and Biochemistry,2021,160:108349. DOI: 10.1016/j.soilbio.2021.108349
[8] FAN K K,DELGADO-BAQUERIZO M,GUO X S,et al. Suppressed N fixation and diazotrophs after four decades of fertilization[J]. Microbiome,2019,7 (1):143. DOI: 10.1186/s40168-019-0757-8
[9] LIU D P,LI M X,LIU Y,et al. Integration of the metabolome and transcriptome reveals the resistance mechanism to low nitrogen in wild soybean seedling roots[J]. Environmental and Experimental Botany,2020,175:104043. DOI: 10.1016/j.envexpbot.2020.104043
[10] LEFF J W,JONES S E,PROBER S M,et al. Consistent responses of soil microbial communities to elevated nutrient inputs in grasslands across the globe[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112 (35):10967−10972.
[11] SCHLATTER D C,BAKKER M G,BRADEEN J M,et al. Plant community richness and microbial interactions structure bacterial communities in soil[J]. Ecology,2015,96 (1):134−142. DOI: 10.1890/13-1648.1
[12] YAN J,HAN X Z,LU X C,et al. Land use indirectly affects the cycling of multiple nutrients by altering the diazotrophic community in black soil[J]. Journal of the Science of Food and Agriculture,2022,102 (9):3788−3795. DOI: 10.1002/jsfa.11727
[13] MA C,ZHANG L C,FENG M,et al. Metabolic profiling unravels the effects of enhanced output and harvesting time on royal jelly quality[J]. Food Research International,2021,139:109974. DOI: 10.1016/j.foodres.2020.109974
[14] LI M X,GUO R,JIAO Y,et al. Comparison of salt tolerance in Soja based on metabolomics of seedling roots[J]. Frontiers in Plant Science,2017,8:1101. DOI: 10.3389/fpls.2017.01101
[15] 袁平丽,何楠,赵胜杰,等. 籽瓜、黏籽和普通西瓜的果实代谢组比较[J]. 中国农业科学,2021,54(19):4179−4195. YUAN P L,HENAN,ZHAO S J,et al. Metabolomics comparative study on fruits of edible seed watermelon, egusi and common watermelon[J]. Scientia Agricultura Sinica,2021,54 (19):4179−4195.
[16] GANUGI P,FIORINI A,ARDENTI F,et al. Nitrogen use efficiency, rhizosphere bacterial community, and root metabolome reprogramming due to maize seed treatment with microbial biostimulants[J]. Physiologia Plantarum,2022,174:e13679.
[17] SHI Z G,WEI F,WAN R,et al. Impact of nitrogen fertilizer levels on metabolite profiling of the Lycium barbarum L. fruit[J]. Molecules,2019,24 (21):3879. DOI: 10.3390/molecules24213879
[18] ZHEN S M,ZHOU J X,DENG X,et al. Metabolite profiling of the response to high-nitrogen fertilizer during grain development of bread wheat (Triticum aestivum L. )[J]. Journal of Cereal Science,2016,69:85−94. DOI: 10.1016/j.jcs.2016.02.014
[19] YANG L Y,WU Q,LIANG H Y,et al. Integrated analyses of transcriptome and metabolome provides new insights into the primary and secondary metabolism in response to nitrogen deficiency and soil compaction stress in peanut roots[J]. Frontiers in Plant Science,2022,13:948742. DOI: 10.3389/fpls.2022.948742
[20] KIM S C,CHAPMAN K D,BLANCAFLOR E B. Fatty acid amide lipid mediators in plants[J]. Plant Science,2010,178 (5):411−419. DOI: 10.1016/j.plantsci.2010.02.017
[21] SUN L,LU Y F,KRONZUCKER H J,et al. Quantification and enzyme targets of fatty acid amides from duckweed root exudates involved in the stimulation of denitrification[J]. Journal of Plant Physiology,2016,198:81−88. DOI: 10.1016/j.jplph.2016.04.010
[22] VAN DAM N M,BOUWMEESTER H J. Metabolomics in the rhizosphere: tapping into belowground chemical communication[J]. Trends in Plant Science,2016,21 (3):256−265. DOI: 10.1016/j.tplants.2016.01.008
[23] GUYONNET J P,GUILLEMET M,DUBOST A,et al. Plant nutrient resource use strategies shape active rhizosphere microbiota through root exudation[J]. Frontiers in Plant Science,2018,9:1662. DOI: 10.3389/fpls.2018.01662
[24] 朱向明,韩秉进. 不同供磷水平下苗期大豆根系形态特征及吸水特性[J]. 土壤与作物,2014,3(3):112−116. ZHU X M,HAN B J. Root morphology and root-water-uptake characteristics of soybean seedlings in response to different levels of phosphorus supply[J]. Soils and Crops,2014,3 (3):112−116.
[25] LUO J,ZHOU J,LI H,et al. Global poplar root and leaf transcriptomes reveal links between growth and stress responses under nitrogen starvation and excess[J]. Tree Physiology,2015,35 (12):1283−1302. DOI: 10.1093/treephys/tpv091
[26] 杨洪强,高华君. 植物精氨酸及其代谢产物的生理功能[J]. 植物生理与分子生物学学报,2007,33(1):1−8. YANG H Q,GAO H J. Physiological function of arginine and its metabolites in plants[J]. Journal of Plant Physiology and Molecular Biology,2007,33 (1):1−8.
[27] 张玉宁,史宏志,王景,等. 高、低硝态氮营养条件下烟草根系基因表达谱及代谢途径的差异分析[J]. 烟草科技,2019,52(4):1−8. ZHANG Y N,SHI H Z,WANG J,et al. Analysis of gene expression profile and metabolic pathway of tobacco root at high and low levels of nitrate nitrogen[J]. Tobacco Science and Technology,2019,52 (4):1−8.
[28] BADRI D V,VIVANCO J M. Regulation and function of root exudates[J]. Plant, Cell and Environment,2009,32 (6):666−681. DOI: 10.1111/j.1365-3040.2009.01926.x
[29] 丁娜,林华,张学洪,等. 植物根系分泌物与根际微生物交互作用机制研究进展[J]. 土壤通报,2022,53(5):1212−1219. DING N,LIN H,ZHANG X H,et al. Interaction mechanism between root secretion and rhizosphere microorganisms: a review[J]. Chinese Journal of Soil Science,2022,53 (5):1212−1219.
[30] VIVES-PERIS V,DE OLLAS C,GÓMEZ-CADENAS A,et al. Root exudates: from plant to rhizosphere and beyond[J]. Plant Cell Reports,2020,39 (1):3−17. DOI: 10.1007/s00299-019-02447-5
[31] GAGE D J. Infection and invasion of roots by symbiotic, nitrogen-fixing rhizobia during nodulation of temperate legumes[J]. Microbiology and Molecular Biology Reviews,2004,68 (2):280−300. DOI: 10.1128/MMBR.68.2.280-300.2004
[32] 徐鹏霞,韩丽丽,贺纪正,等. 非共生生物固氮微生物分子生态学研究进展[J]. 应用生态学报,2017,28(10):3440−3450. XU P X,HAN L L,HE J Z,et al. Research advance on molecular ecology of asymbiotic nitrogen fixation microbes[J]. Chinese Journal of Applied Ecology,2017,28 (10):3440−3450.
[33] RODRIGUES COELHO M R,DE VOS M,CARNEIRO N P,et al. Diversity of nifH gene pools in the rhizosphere of two cultivars of Sorghum (Sorghum bicolor) treated with contrasting levels of nitrogen fertilizer[J]. FEMS Microbiology Letters,2008,279 (1):15−22. DOI: 10.1111/j.1574-6968.2007.00975.x
[34] WANG C,ZHENG M M,SONG W F,et al. Impact of 25 years of inorganic fertilization on diazotrophic abundance and community structure in an acidic soil in Southern China[J]. Soil Biology and Biochemistry,2017,113:240−249. DOI: 10.1016/j.soilbio.2017.06.019
[35] ZHU C,FRIMAN V P,LI L,et al. Meta-analysis of diazotrophic signatures across terrestrial ecosystems at the continental scale[J]. Environmental Microbiology,2022,24 (4):2013−2028. DOI: 10.1111/1462-2920.15984
-
期刊类型引用(3)
1. 谢勇俊,秦文连,周婧,王孟佳,潘小卓,秦孝杰,唐景美,王一兵. 火龙果连作土壤细菌多样性与酶活性对酚酸类代谢产物的响应特征. 农业生物技术学报. 2025(01): 30-42 .  百度学术
百度学术
2. 梁爽,张璨,周雅男,胡蕾蕾,罗华影,车钊,董召荣,王晓波,宋贺. 施氮量对大豆氮同化和根际土壤氮转化的影响. 西北农业学报. 2025(02): 211-221 .  百度学术
百度学术
3. 刘效俊. 新蔡县大豆土壤肥料管理技术探讨. 南方农业. 2024(24): 28-30 .  百度学术
百度学术
其他类型引用(7)



 下载:
下载: